Droplet Digital PCR ddPCR Meningkatkan Akurasi Kuantifikasi DNA

Droplet Digital PCR ddPCR adalah metode PCR digital yang berbasis teknologi droplet (emulsi air-minyak). Droplet yang terbentuk dari emulsi air-minyak akan membentuk partisi yang memisahkan molekul DNA sampel. Droplet pada dasarnya memiliki fungsi yang sama dengan tabung reaksi individu atau pelat sumur (well plate ) tempat reaksi PCR berlangsung, namun dalam format yang jauh lebih kecil. Sampel difraksinasi menjadi 20.000 droplet, dan amplifikasi dari molekul DNA terjadi di setiap individu droplet.
Partisi sampel dalam jumlah besar adalah aspek kunci dari teknik ddPCR. Pada real-time PCR, pengukuran amplifikasi dari satu sampel dilakukan hanya dari satu kumpulan DNA sampel, tetapi pada ddPCR, sampel dipartisi menjadi 20.000 droplet berukuran nanoliter dan pengukuran amplifikasi dilakukan secara independen pada setiap droplet yang mengandung DNA dari satu sampel yang sama. Tujuan dari partisi tersebut salah satunya adalah untuk dilusi inhibitor yang ada pada reaksi PCR sehingga akan meningkatkan sensitivitas reaksi.
 Baca juga : Teknologi Lateral Flow Assay (LFA) dan Proses Produksinya
Baca juga : Teknologi Lateral Flow Assay (LFA) dan Proses Produksinya
Keunggulan ddPCR dibanding Teknologi Digital PCR lainnya
Saat ini ada 2 pendekatan utama dalam teknik digital PCR, metode berbasis ruang dan metode berbasis droplet. Metode berbasis ruang menggunakan partisi solid-state (ruang) yang dibuat khusus. Metode digital PCR berbasis ruang menggunakan teknologi sistem fluida dan pompa. Campuran reaksi PCR (reagen PCR dan sampel DNA) akan disuntikan ke dalam solid-state, kemudian sistem pompa akan bekerja untuk mendispersi campuran reaksi agar masuk ke dalam partisi ruang.
Seperti halnya dengan well plate, solid-state adalah bahan habis pakai yang tidak dapat digunakan kembali. Jumlah dan ukuran partisi solid-state yang digunakan sangat konsisten, namun jumlah partisi dan reaksi yang terjadi seringkali lebih rendah dikarenakan beberapa hal antara lain adanya kontaminasi debu atau inhibitor lainnya pada partisi ruang atau faktor sistem pompa fluida untuk dispersi yang kurang maksimal.
Pada ddPCR, partisi dilakukan dengan membuat droplet emulsi air-minyak dalam jumlah besar. Setiap droplet mengandung campuran cetakan DNA dan reagen PCR sehingga akan terjadi reaksi amplifikasi secara independen dalam setiap droplet, kemudian reader akan mengukur proses amplifikasi melalui floresensi yang dihasilkan dari setiap droplet. Pembuatan droplet, proses amplifikasi, dan pembacaan floresensi dilakukan dengan menggunakan mesin yang berbeda, sehingga berbeda dengan metode berbasis ruang, hasil amplifikasi dari ddPCR dapat dilanjutkan untuk uji konfirmasi menggunakan sekuensing (amplicon recovery).
 Kuantifikasi DNA dengan ddPCR tanpa Kurva Standar
Kuantifikasi DNA dengan ddPCR tanpa Kurva Standar
Berbeda dengan real-time PCR, kuantifikasi DNA dengan sistem ddPCR tidak memerlukan kurva standar sebagai pembanding, dikenal sebagai kuantifikasi absolut. Pada sistem ddPCR, DNA target ditandai dengan probe berbasis fluoresensi. Droplet positif (1), yang mengandung setidaknya satu salinan target akan menunjukkan peningkatan fluoresensi di atas droplet negatif (0).
Setelah amplifikasi dengan end-point PCR, droplet positif dan negatif dihitung secara individual pada pembacaan droplet dengan melewatkannya dalam satu aliran melalui detektor fluoresensi dengan cara yang mirip dengan flow cytometry. Perangkat lunak dari sistem akan menentukan jumlah droplet yang positif dan negatif untuk setiap fluorofor (misalnya, FAM dan HEX atau VIC) di setiap sampel. Fraksi droplet positif kemudian dianalisis dengan distribusi Poisson untuk menentukan jumlah salinan DNA awal secara absolut dalam satuan salinan/µl sampel.
 Kuantifikasi DNA dengan ddPCR tanpa Terpengaruh Efisiensi Reaksi PCR
Kuantifikasi DNA dengan ddPCR tanpa Terpengaruh Efisiensi Reaksi PCR
Droplet Digital PCR ddPCR memiliki sensitivitas lebih tinggi dibandingkan generasi PCR sebelumnya karena adanya proses partisi. Proses tersebut membuat ddPCR lebih toleran terhadap inhibitor reaksi PCR atau perubahan suhu penempelan primer saat proses amplifikasi. Berbeda dengan real-time PCR dimana perubahan suhu sangat mempengaruhi efisiensi reaksi, yang secara langsung akan berpengaruh pada nilai Cq amplifikasi dan penghitungan nilai salinan DNA (kuantifikasi DNA), perubahan suhu pada ddPCR akan berpengaruh terhadap intensitas floresensi reaksi namun tidak pada penghitungan nilai salinan DNA.
Hal tersebut karena sistem pengukuran ddPCR berbeda dengan real-time PCR. Real-time PCR mengukur akumulasi floresensi pada satu sampel, sedangkan ddPCR mengukur akumulasi floresensi pada setiap droplet, dimana satu sampel akan mengandung ribuan droplet.
Baca juga : Cara Deteksi Cepat Salmonella dengan Bio-Rad Salmonella Solutions
Kuantifikasi DNA dengan Presisi Tinggi menggunakan ddPCR
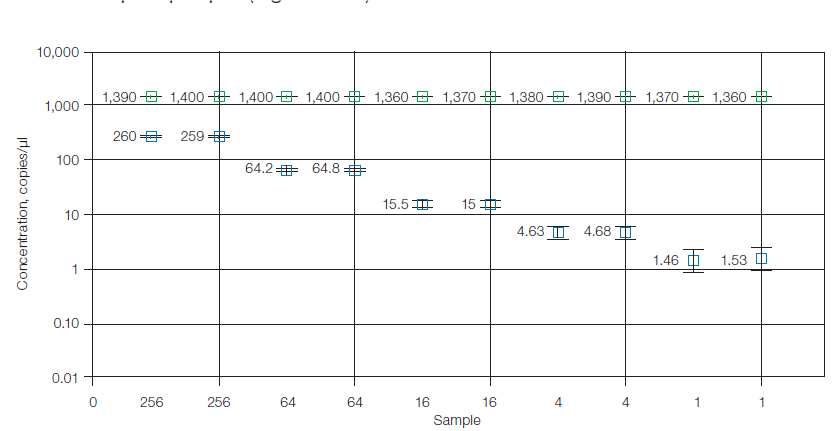
Droplet Digital PCR ddPCR dapat membedakan jumlah salinan DNA pada setiap sampel yang memiliki perbedaan nilai Cq hingga 0,3 Cq di Real-time PCR. Hal tersebut karena sistem analisis ddPCR menggunakan teknologi mirip seperti flow cytometry sehingga memiliki sensitivitas dan presisi yang sangat tinggi. Berbeda dengan teknologi digital PCR lainnya yang mengadopsi sistem analisis seperti real-time PCR. Presisi tinggi sangat penting untuk analisis DNA dengan konsentrasi rendah atau sampel-sampel yang memiliki salinan DNA dengan nilai perbedaan yang sangat kecil, sebagai contoh apabila kita ingin melakukan penelitian variasi jumlah salinan DNA pada sampel yang homogen.
Penulis : Ahmad Furqoni M.Si
Editor : Agung Nurfaizal
Phone : 021 5366 7591
Email : [email protected]
WhatsApp : 0855 1288 801
Kunjungi media sosial kami dan blog Offical Sciencewerke:
Instagram: https://www.instagram.com/sciencewerke_id/
Linkedin: https://www.linkedin.com/company/pt-sciencewerke/