Droplet Digital PCR untuk Autentikasi Halal

Kary Mullis pada awal tahun 1985 mengembangkan metode Polymerase Chains Reaction (PCR) pertama kalinya. Metode PCR mempunyai kemampuan untuk menggandakan DNA dengan mencampurkan cetakan (DNA template), primers, basa nukleotida, dan enzim polimerasi. Reaksi PCR berlangsung secara berulang dengan menggunakan tiga titik suhu yang berbeda, yang lebih dikenal dengan tahapan denaturasi, penempelan dan pemanjangan primers. Bagian DNA yang menjadi target spesifik digandakan dari genom DNA dan menghasikan jutaan copy yang identik.
PCR hingga saat ini sudah mengalami perkembangan yang sangat maju, dimulai dari PCR konvensional (Thermal Cycler), Quantitative PCR (qPCR) sampai pada Digital PCR. Metode PCR konvensional bersifat kualitatif dimana hanya dapat melihat ada atau tidaknya amplifikasi DNA yang ditunjukkan dari hasil elektrogram. qPCR merupakan generasi ke-2 dari PCR yang dikembangkan dengan tujuan untuk melakukan kuantifikasi DNA (copy number) dengan membandingkan data real-time dari proses penggandaan DNA target dengan standar DNA yang telah diketahui jumlahnya. Pengujian kuantitatif pada metode qPCR memerlukan standar DNA sebagai pembanding. Generasi ke-3 dari PCR (digital PCR) dikembangkan dengan kemampuan kuantifikasi DNA secara absolut tanpa memerlukan standar DNA atau kurva standar. Sistem ini mempunyai tingkat sensitivitas lebih tinggi dibanding dua generasi PCR sebelumnya.
Baca juga : Deteksi Leukemia Akurat Dengan Menggunakan FISH (Fluorescence In Situ Hybridization)
Digital PCR, atau yang dikenal sebagai droplet digital PCR (ddPCR), merupakan teknologi revolusioner dari PCR. Metode ini bersifat sangat sensitif sehingga dapat mendeteksi sampel DNA dalam jumlah kecil (low copy number). Teknologi ddPCR memiliki prinsip dasar pembentukan droplet (partisi sampel dalam jumlah kecil). Sampel DNA yang sudah diisolasi kemudian dipartisi ke dalam bentuk droplet yang sudah dicampur dengan komponen PCR lainnya melalui metode mikrofluidik. Sebanyak 20,000 droplet berukuran ~1 nanoliter dihasilkan oleh setiap sampel dalam satu kali running pada sistem ddPCR (Gambar 1).
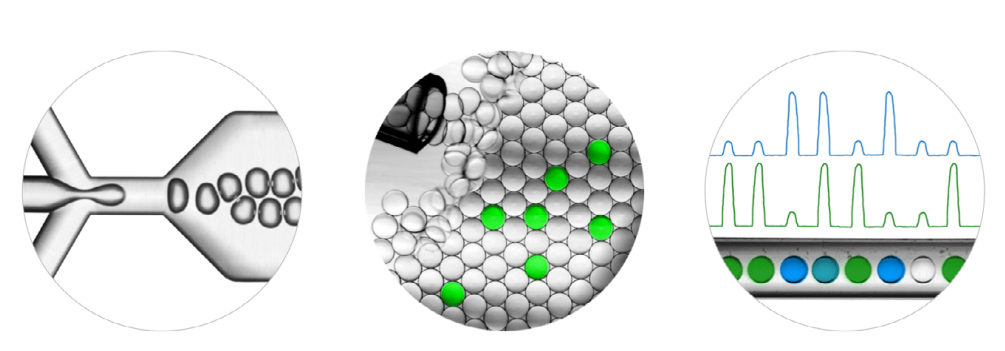
Gambar 1 Proses partisi droplet pada sistem dPCR
Proses penggandaan dilakukan untuk menguatkan sinyal flouresens pada sampel. Apabila di dalam droplet terdapat target dan terjadi penggandaan DNA maka droplet akan memberikan pendaran dan sebaliknya bila dalam sebuah droplet tidak terdapat target maka droplet tidak akan berpendar. Setiap droplet dibaca melalui sistem seperti “flow cytometry” dimana droplet dibaca satu persatu oleh sistem sensor/deteksi. Jika ada pendaran hasil dicatat sebagai score 1 (positif) dan jika tidak ada pendaran dicatat sebagai score 0 (negatif). Proses tersebut berlangsung hingga semua droplet terbaca dan kemudian secara otomatis alat akan menghitung jumlah droplet positif dan negatif. Sistem kuantifikasi absolut ditentukan dari proporsi jumlah droplet yang positif relatif terhadap jumlah total dan volume total droplet (Gambar 2).
Gambar 2 Prinsip kerja ddPCR
Beberapa keunggulan ddPCR (Gambar 3) dibandingkan dengan generasi pertama PCR (thermal cycler) dan generasi kedua PCR (qPCR) antara lain sebagai berikut:
• Merupakan satu-satunya metode PCR yang memiliki kemampuan absolut kuantitatif (tanpa memerlukan kurva standar),
• Merupakan metode PCR yang dapat mendeteksi sampel DNA dengan konsentrasi yang sangat rendah tanpa mengurangi akurasi dan presisinya,
• Proses partisi droplet, 1 reaksi ~ 20,000 droplet, meningkatkan efisiensi metode PCR,
• Mampu mendeteksi keberadaan inhibitor pada sampel,
• Dapat diaplikasikan pada sampel yang kompleks dengan mereduksi bias yang dihasilkan oleh inhibitor,

Gambar 3. Tiga generasi PCR, (a) Thermal Cycler (b) real-time PCR(qPCR) (c) droplet digital PCR
Pemanfaatan ddPCR untuk Deteksi Kandungan DNA non-Halal
Kewajiban mengkonsumsi makanan halal bagi umat muslim telah didukung dengan adanya Undang-Undang No.33 Tahun 2014 tentang Jaminan Produk Halal. Dalam UU tersebut menjelaskan bahwa semua produk yang masuk, beredar dan diperdagangkan di Indonesia harus tersertifikasi halal. Berbagai metode analisis kandungan non-halal telah banyak dilakukan, dapat berupa analisis lemak, protein dan DNA. Analisis kandungan non-halal lebih spesifik dengan menargetkan pada DNA-nya menggunakan metode Polymerase Chain Reaction (PCR).
Konvensional PCR atau thermal cycler PCR merupakan metode PCR yang paling sederhana dalam pengerjaan dan analisis, namun metode tersebut memiliki kelemahan dalam hal sensitivitas dan hanya dapat digunakan untuk analisis kualitatif. Analisis kandungan DNA non-halal dengan metode qPCR merupakan metode PCR yang paling banyak digunakan untuk autentifikasi halal, namun analisis kandungan DNA non-halal menggunakan qPCR sangat dipengaruhi oleh efisiensi amplifikasi dan memerlukan kurva standar untuk mengkonversi nilai Ct (cycle threshold) dalam pengukuran jumlah (copy number) DNA target. Oleh karena itu, metode tersebut umumnya digunakan untuk analisis kandungan DNA non-halal yang memiliki konsentrasi cukup tinggi dan matriks sampel yang tidak banyak mengandung inhibitor PCR.
Tes darah
Tes usap tenggorokan
Biopsi kulit, dengan mengambil sampel jaringan kulit untuk diperiksa dengan mikroskop
Tes PCR
Deteksi Cacar Monyet Cepat dalam 1,5 jam dengan Seegene Novaplex™ MPXV Assay (RUO)
Tes PCR dikenal sebagai standar emas untuk mendeteksi MPXV secara akurat, sehingga dapat digunakan secara efektif untuk mencegah penyebaran virus yang cepat.
Novaplex™ MPXV Assay (RUO) adalah produk PCR real-time yang secara akurat mendeteksi MPXV secara khusus dengan satu tes. Produk ini dapat digunakan dengan sistem otomatisasi untuk alur kerja yang nyaman, dan dapat digunakan sebagai uji konfirmasi untuk infeksi MPXV.
Fitur Utama
Deteksi khusus untuk virus monkeypox
Secara khusus mendeteksi gen target MPXV dengan penerapan teknologi Seegene TOCE™
Mencakup semua clades: Afrika Barat, clades Congo Basin
Sistem Otomatis
Menyediakan alur kerja yang nyaman melalui sistem otomatisasi yang disederhanakan
Meminimalkan kontaminasi dan kesalahan manusia
PCR TAT Cepat
Mengurangi waktu pengujian dengan PCR TAT cepat 1,5 jam
Sumber: alodokter.com & seegene.com
Hubungi Kami Untuk Ketersediaan Produk
Phone : 021 5366 7591
Email : [email protected]
WhatsApp : 0855 1288 801
Kunjungi media sosial kami dan blog Offical Sciencewerke:
Instagram: https://www.instagram.com/sciencewerke_id/
Linkedin: https://www.linkedin.com/company/pt-sciencewerke/