Pewarnaan Gel Protein : Metode Mana yang Paling Cocok untuk Riset Anda
Protein yang sudah diseparasi dengan metode elektroforesis dapat dilihat dengan menggunakan berbagai metode pewarnaan. Pemilihan tehnik pewarnaan bergantung pada keberadaan jenis imager untuk deteksi, sensitifitas, dan kompatibilitas untuk analisis selanjutnya, seperti western blot, LCMS-MS, 2D electrophoresis, dan analisis lainnya. Beberapa jenis pewarna protein yang banyak digunakan diantaranya coomassie, fluorescent, silver, dan pewarnaan negatif. Untuk membuat protein target terlihat, kita bisa menggunakan dye-binding atau bahan kimia yg menghasilkan warna pada protein yg berada dalam gel poliakrilamid. Tergantung bahan kimia yg terkandung di dalamnya, setiap metode pewarnaan mungkin memiliki prosedur dan bahan- bahan yang berbeda pada proses pewarnaanya. Proses pewarnaan protein pada gel elektroforesis dilakukan dengan proses perendaman. Biasanya, pada gel masih terdapat detergen seperti SDS yang masih tersisa dan residu running buffer. Secara umum, proses pewarnaan protein adalah sebagai berikut :
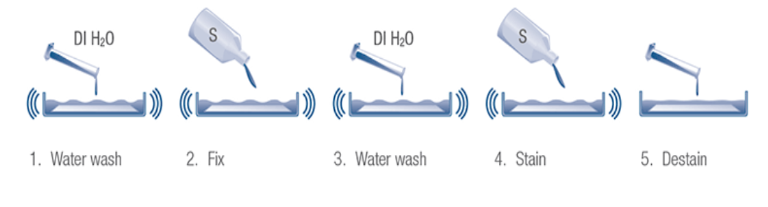
- Gel dimasukkan ke dalam wadah, lalu direndam menggunakan distilled water untuk menghilangkan buffer elektroforesis dari gel
- Gel ditambahkan asam (eg. acetic acid) atau alkohol untuk poses fiksasi gel dan mengurangi potensi proses difusi protein dari gel
- Penambahan larutan pewarna dan direndam selama waktu tertentu agar pewarna atau bahan kimia pewarna masuk ke dalam gel dan berikatan atau bereaksi dengan protein
- Proses destaining untuk menghilangkan sisa-sisa pewarna yang masih menempel secara acak di gel elektroforesis dan agar gambar yg dihasilkan memiliki background yg bersihl
Beberapa hal yang harus diperhatikan sebelum proses pewarnaan gel adalah sebagai berikut : sensitifitas pewarnaan yang ingin dicapai, kompatibilitas dengan analisis lanjutan, kompleksitas protokol yang digunakan, dan dynamic range dari hasil pewarnaannya. Secara umum pewarnaan protein dibagi menjadi 2 jenis, yaitu pewarnaan positif dan pewarnaan negatif. Pada pewarnaan positif yang diwarnai adalah proteinnya, sedangkan pada pewarnaan negatif yang diwarnai adalah gelnya. Jenis-jenis pewarnaan positif diantaranya coomassie, silver stain, dan fluorescent stain, sedangkan pewarnaan negatif diantaranya adalah zinc staining.
Coomassie Brilliant Blue
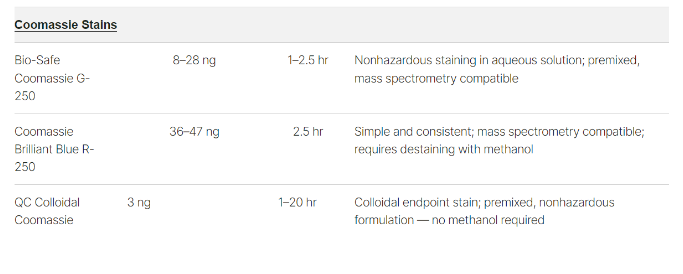
Merupakan jenis pewarna anionik yang paling populer dan banyak digunakan yang dapat mewarnai hamper semua jenis protein dengan hasil linieritas yang baik dangan sensitifitas medium. Hasil pewarnaan dengan coomassie menghasilkan warna biru pada protein dalam gel (Gambar 1). Ada 2 jenis coomassie brilliant blue, yaitu R-250 (R, reddish) dan G-250 (G, greenish). Coomassie Blue R-250 paling banyak digunakan, karena harganya yang lebih murah, proses pewarnaan cepat, dan dapat digunakan untuk mewarnai protein dengan hasil sensitifitas yang baik (36–47 ng protein). Namun, jenis pewarna ini kurang baik terhadap lingkungan limbanhnya, sehingga harus hati-hati dalam pembuangan limbahnya. Coomassie Blue G-250 memiliki sensitifitas pewarnaan yang lebih baik (8–28 ng protein) daripada R-250 dan lebih aman terhadap lingkungan formulanya (Simpson 2010, Neuhoff et al. 1988)
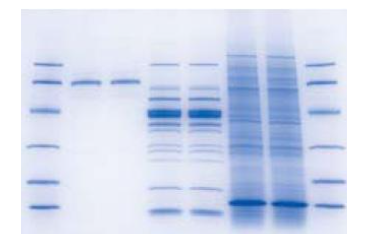
Gambar 1. Hasil pewarnaan gel SDS-PAGE dengan pewarna Bio-Safe Coomassie Stainl
Baca juga : Pentingnya syndromic testing (multiplex PCR) untuk identifikasi penyakit pneumonia
Pewarna coomassie juga merupakan pewarna favorit yang digunakan untuk analisis lanjutan mass spectrometry dan identifikasi protein. BioRad Laboratories mengembangkan Bio-Safe Coomassie Stain (Cat#161-0786) yang merupakan formulasi Coomassie Blue G-250 yang tidak berbahaya yang hanya membutuhkan air untuk membilas dan menghilangkan sisa pewarna. Sensitifitas dari jenis pewarna ini juga lebih baik dari Coomassie R- dan setara dengan Coomassie Blue G-250, tetapi dengan protokol pewarnaan yang lebih sederhana dan lebih cepat. Selain itu, BioRad juga membuat formulasi terbaru yaitu QC Colloidal Coomassie (Cat#161-0803) yang merupakan jenis Coomassie G-250 dengan sensitifitas paling tinggi (3 ng protein) dengan proses staining dan destining yang fleksibel tanpa membutuhkan methanol untuk proses fiksasinya. Berikut adalah detail jenis pewarna Coomassie Brilliant Blue dari BioRad Laboratories :
Silver Stains
Pewarnaan dengan menggunakan silver dapat menghasilkan sensitivitas yang paling tinggi (0.6–1.2 ng protein) dibanding metode yg lainnya, namun dynamic rangenya rendah (Merril et al. 1981, Rabilloud et al. 1994). Terkadang protokolnya membutuhkan waktu yg lama, kompleks, dan kurang reproducible untuk analisis kuantitatif. Pewarnaan dengan metode ini, kompatibel dengan analisis lanjutana mass spectrophotometry, namun lebih rendah dibandingkan pewarnaan dengan coomassie blue dan pewarnaan fourescnet (Yan et al. 2000). Sensitivitas pewarnaan dengan silver stain melebihi sensitivitas dengan pewarnaan coomassie, sehingga cocok untuk mendeteksi protein yg konsentrasinya sangat sedikit dalam gel, misalnya untuk mengecek protein marker dan sensitivitasnya sepadan dengan pewarna fluorescent. Hasil pewarnaan dengan silver menghasilkan warna cokelat kehitaman pada protein gel (Gambar 2).
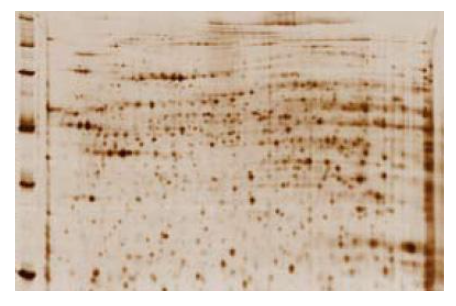
Gambar 2. Hasil pewarnaan 2D gel dengan Bio-Rad Silver Stain
Tehnik pewarnaan dengan silver meliputi deposisi metallic silver pada permukaan gel yang berisi protein target, lalu ion silver (dari silver nitrat) berinteraksi dan berikanan dengan gugus fungsional pada protein. Interaksi yang paling kuat terjadi pada carboxylic acid groups (Asp dan Glu), imidazole (His), sulfhydryls (Cys), and amines (Lys). Penambahan reagent sensitizer and enhancer juga dilakukan untuk mengontrol spesifisitas dan efisiensi pengikatan ion silver terhadap protein. Salah satu produk pewarnaan yang dapat digunakan adalah Silver Stain Plus™ (Cat# 1610449) dari BioRad Laboratories. Pewarna ini dikembangkan dari metode yg didevelop oleh Gottlieb and Chavko (1987) yang sudah disempurnakan untuk mendeteksi protein dan asam nukleat dari gel poliakrilamid dan agarosa. Silver Stain Plus kit dapat mendeteksi hingga 0.6 ng of protein dan DNA, dan hanya membutuhkan 3 tahapan dalam waktu kurang dari 1 jam. Hasil pengujian menunjukkan sensitifitasnya 10-50x lebih sensitive dari Coomassie Brilliant Blue R-250 pada pewarnaan protein dan 2-5x lebih sensitive dari ethidium bromide pada pewarnaan DNA dan RNA.
Fluorescent Stains
Pewarnaan dengan fluorescent merupakan pewarnaan paling ideal dibanding yg lainnya, karena menghasilkan sensitifitas yang tinggi (sebanding dengan silver stain), dynamic range luas (hingga 4 orders of magnitude), protokol yg simple dan mudah, dan compatible untuk analisis mass spectrophotometry. Namun, jika dibandingkan dengan pewarnaan coomassie dan silver, pewarnaan dengan fluorescent membutuhkan biaya lebih mahal dan harus divisualisasi menggunakan gel doc dengan CCD kamera atau fluorescent scanner. Karena alasan tersebut, pewarnaan dengan fluorescent bisanya banyak digunakan dalam pengujian proteomic yang lebih kompleks, seperti 2D gel electrophoresis yang membutuhkan sensitifitas dan dynamic range yang tinggi, sehingga bisa melihat lebih detail perbedaan spot protein spesifik yang berbeda antara 2 sampel (Gambar 3).
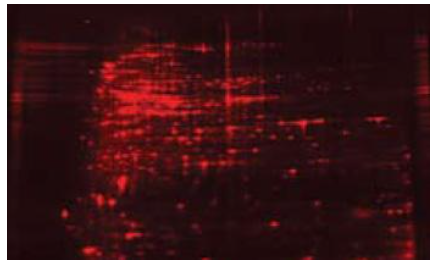
Gambar 3. Hasil pewarnaan 2D gel dengan SYPRO Ruby stain
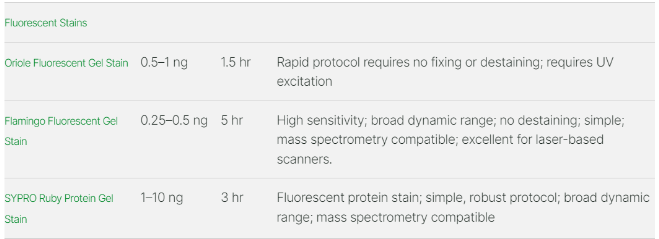
Berikut ini adalah contoh beberapa produk fluorescent stain dari BioRad Laboratories :
Stain-Free Technology
Teknologi Stain-free merupakan teknologi yang dipatenkan oleh BioRad Laboratories, untuk mempercepat dan mempermudah analisis gel hingga western blot. Dengan teknologi stain-free kita bisa melakukan visualisasi protein dalam gel SDS-PAGE atau membrane tanpa proses staining dan destaining terlebih dahulu, sehingga prosesnya jadi lebih cepat. Sensitivitas pewarnaan dengan teknologi ini juga lebih baik dibandingkan coomassie brilliant blue R-250 dengan sensitifitas hingga 10-25 ng protein (Gambar 4).
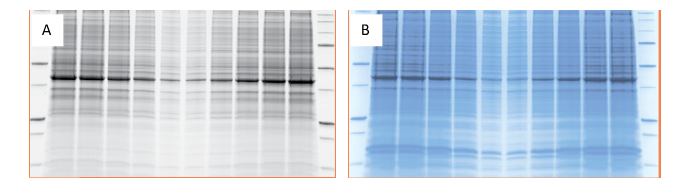
Gambar 4. (A) Hasil foto gel dengan teknologi stain-free dengan aktivasi gel & imaging selama 1 menit dan (B)
hasil pewarnaan dengan coomassie blue selama semalaman
Teknologi stain-free juga memiliki beberapa keunggulan dalam analisis kuantitatif western blot. Hasil pewarnaan dengan teknologi ini bisa langsung dilanjutkan ke proses blotting tanpa running 2 gel, sehingga akan lebih hemat. Dengan teknologi ini juga, peneliti dapat melakukan analisis normalisasi total protein dab visualisasi pre dan post transfer. Ini akan sangat memudahkan untuk melekukan check point pada tahapan western blot. Analisis normalisasi total protein juga dapat digunakan sebagai alternative penggunakan housekeeping protein sebagai normalisator dalam analisa western blot.
Kunjungi laman berikut untuk mengetahui lebih detail tentang teknologi stain-free.
Referensi :
- Agrawal GK and Thelen JJ (2009). A high-resolution two dimensional Gel- and Pro-Q DPS-based proteomics workflow for phosphoprotein identification and quantitative profiling. Methods Mol Biol 527, 3–19.
- Gottlieb M and Chavko M (1987). Silver staining of native and denatured eukaryotic DNA in agarose gels. Anal Biochem 165(1), 33–37.
- Hart C et al. (2003). Detection of glycoproteins in polyacrylamide gels and on electroblots using Pro-Q Emerald 488 dye, a fluorescent periodate Schiff-base stain. Electrophoresis 24, 588–598.
- Merril CR (1987). Detection of proteins separated by electrophoresis. Adv Electrophoresis 1, 111–139.
- Merril CR et al. (1981). Ultrasensitive stain for proteins in polyacrylamide gels shows regional variation in cerebrospinal fluid proteins. Science 211, 1437–1438.
- Miller I et al. (2006). Protein stains for proteomic applications: which, when, why? Proteomics 6, 5385–5408.
- Neuhoff V et al. (1988). Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear backgrounds at nanogram sensitivity using G-250 and R–250. Electrophoresis 9, 255–262.
- Rabilloud T et al. (1994). Silver-staining of proteins in polyacrylamide gels: a general overview. Cell Mol Biol 40, 57–75.
- Simpson RJ (2010). Rapid coomassie blue staining of protein gels. Cold Spring Harb Protoc, pdb prot5413.
- Steinberg TH et al. (2003). Global quantitative phosphoprotein analysis using multiplexed proteomics technology. Proteomics 3, 1128–1144.
- Yan JX et al. (2000). A modified silver staining protocol for visualization of proteins compatible with matrix-assisted laser desorption/ionization and electrospray ionization-mass spectrometry. Electrophoresis 21, 3666–3672.
Baca juga : Disrupsi Sampel Laboratorium Berbasis Bead Mill untuk Mendukung Ekstraksi Molekuler
Mari Terhubung dengan Kami
Phone : 021 5366 7591
Email : [email protected]
WhatsApp : 0858 8880 0004
Kunjungi media sosial Offical Sciencewerke:
Instagram: https://www.instagram.com/sciencewerke_id/
Linkedin: https://www.linkedin.com/company/pt-sciencewerke/