Teknologi Lateral Flow Assay (LFA) dan Proses Produksinya
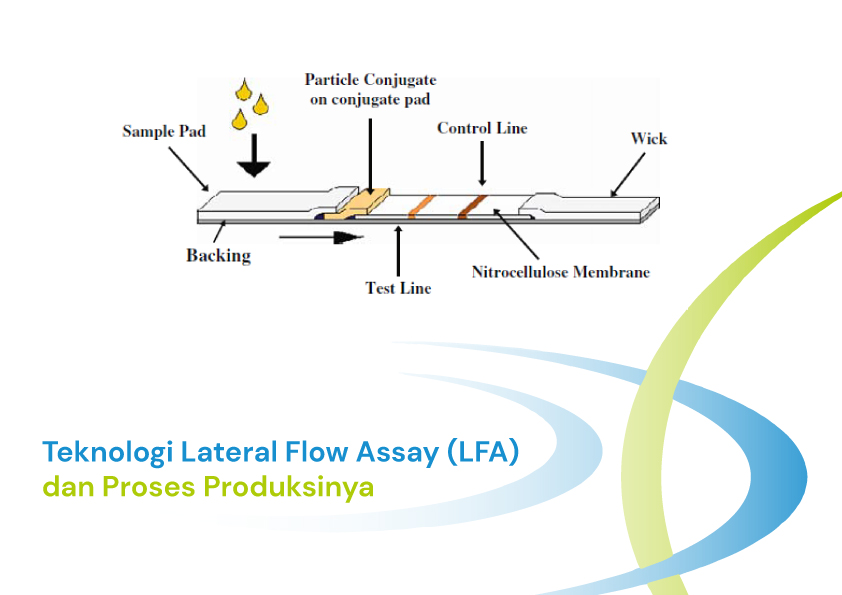
Lateral flow assay (LFA)/Rapid-test/ POCT merupakan teknologi yang berbasis kertas (papes-based paltform) yang dapat digunakan untuk mendeteksi analit dalam suatu sampel kompleks. Sample diletakkan dalam test device dan hasilnya akan muncul dalam waktu 5 – 30 menit. Teknologi ini dapat digunakan untuk mendeteksi secara cepat kandungan antibodi, antigen, asam nukleat, dan bahan kimia lainnya dalam sampel. Kelebihan dari teknologi ini diantaranya : murah, cepat, mudah digunakan, simpel, memiliki umur simpan yg lama, tidak memerlukan penyimpanan dingin, dan tidak memerlukan alat pembaca tambahan. Kesederhanaan teknologi ini sangat cocok untuk diagnosis point-of-care atau field-based.
Baca juga : Penyebab Cacar Monyet Dan Cara Cepat Deteksi Cacar Monyet
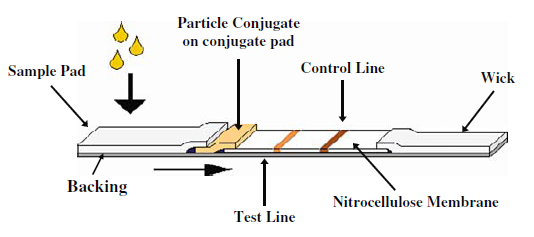
Lateral flow assay terdiri dari beberapa komponen yang disatukan menjadi test strip. Komponen tersebut adalah backing card, sample pad, conjugate pad, nitrocellulose membrane, dan wick/absorbent pad (Gambar 1). Backing card berfungi menopang dan menahan komponen-komponen lainnya agar bisa menyatu, biasanya terbuat dari polystyrene atau plastic lainnya. Sample pad berfungsi untuk absorbs sampel, separasi dari pengotor, dan mengontrol distribusi dan flow sampel ke conjugate pad. Conjugate pad merupakah tempat meletakkan antibody untuk target analit yang sudah dikonjugasikan dengan gold nanoparticle sebagai pewarna. Nitrocellulose membrane merupakan media untuk mengimobilisasi antibody deteksi dan antibody kontrol. Wick pad berfungsi memberikan aliran kapiler yang seragam melalui membran, menyerap sampel dan mencegah backflow.
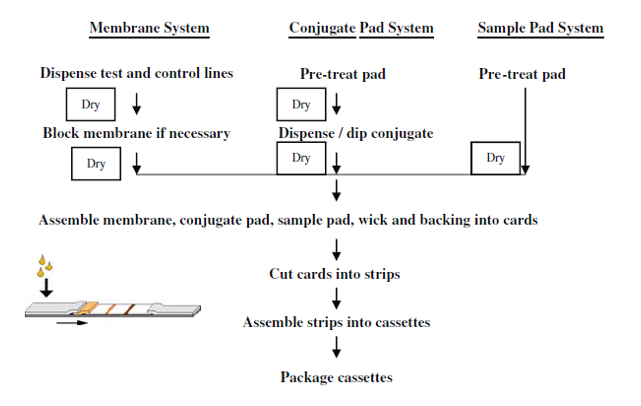
 RINGKASAN PROSES PRODUKSI LATERAL FLOW ASSAY
RINGKASAN PROSES PRODUKSI LATERAL FLOW ASSAY
Dalam produksi lateral flow assay ada 2 jenis skema produksi yang dibedakan berdasarkan input material yang digunakan dan skala produksinya, yaitu batch manufacture dan continuous/in line manufacture. Batch manufacture cocok digunakan untuk tahapan R&D dan produksi rapid test skala kecil-menengah. Input material yang digunakan berupa material yang sudah dipotong sesuai standard produksi (biasanya 300 mm). Sedangkan continuous manufacture cocok digunakan untuk produksi skala besar dan hasil pengembangan dari R&D. Input material yang digunakan berupa roll format. Berikut merupakan perbedaan atara batch manufacture dan continuous/in line manufacture:
 Dalam produksi lateral flow assay ada 2 jenis skema produksi yang dibedakan berdasarkan input material yang digunakan dan skala produksinya, yaitu batch manufacture dan continuous/in line manufacture. Batch manufacture cocok digunakan untuk tahapan R&D dan produksi rapid test skala kecil-menengah.
Dalam produksi lateral flow assay ada 2 jenis skema produksi yang dibedakan berdasarkan input material yang digunakan dan skala produksinya, yaitu batch manufacture dan continuous/in line manufacture. Batch manufacture cocok digunakan untuk tahapan R&D dan produksi rapid test skala kecil-menengah.
Pada tahapan ini ada 2 bahan yang didispense, yaitu antibody target yang sudah terkonjugasi dengan gold nanoparticle dan antibody deteksi (test dan control line). Proses ini dilakukan dengan menggunakan alat dispenser yang sudah dilengkapi dengan dispenser spray dan line atau dot. Antibody conjugated didispense di atas conjugate pad dengan menggunakan dengan menggunakan sprayer (AirJet HR atau µAirJet dispenser) atau menggunakan metode deep coating menggunakan deep tray atau deep tank (Gambar 2).
 Antibody deteksi didispense diatas membrane nitrocelluloce dengan menggunakan line atau dot dispenser. Ada 2 kelompok dispenser yang biasa digunakan yaitu non-contact (BioJet HR) dan contact (Frontline HR) (Gambar 3). Pada dispenser non-contact, letak tip berada diatas membrane dengan jarak tertentu (bisa diatur) sehingga tidak terjadi kontak langsung. Dispenser jenis ini memberikan hasil yg terbaik pada proses dispensing, karena tidak berpotensi merusak membrane dan jumlah antibody yang didispense juga lebih presisi. Selain bisa untuk membuat line, dispenser BioJet HR juga bisa digunakan untuk dispense dalam bentuk dot (titik). Dispenser contact juga dapat digunakan sebagai alternative. Pada dispenser jenis ini, tip berada sangat dekat sekali dengan membrane atau bahkan menempel pada membrane. Dispenser jenis ini lebih murah, namun harus sangat hati2 dalam aplikasinya karena berpotensi merusak membrane jika terlalu menempel.
Antibody deteksi didispense diatas membrane nitrocelluloce dengan menggunakan line atau dot dispenser. Ada 2 kelompok dispenser yang biasa digunakan yaitu non-contact (BioJet HR) dan contact (Frontline HR) (Gambar 3). Pada dispenser non-contact, letak tip berada diatas membrane dengan jarak tertentu (bisa diatur) sehingga tidak terjadi kontak langsung. Dispenser jenis ini memberikan hasil yg terbaik pada proses dispensing, karena tidak berpotensi merusak membrane dan jumlah antibody yang didispense juga lebih presisi. Selain bisa untuk membuat line, dispenser BioJet HR juga bisa digunakan untuk dispense dalam bentuk dot (titik). Dispenser contact juga dapat digunakan sebagai alternative. Pada dispenser jenis ini, tip berada sangat dekat sekali dengan membrane atau bahkan menempel pada membrane. Dispenser jenis ini lebih murah, namun harus sangat hati2 dalam aplikasinya karena berpotensi merusak membrane jika terlalu menempel.
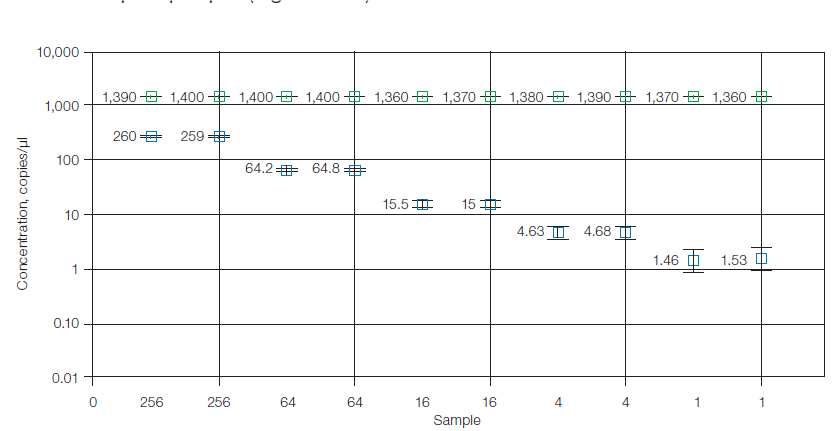
Setelah amplifikasi dengan end-point PCR, droplet positif dan negatif dihitung secara individual pada pembacaan droplet dengan melewatkannya dalam satu aliran melalui detektor fluoresensi dengan cara yang mirip dengan flow cytometry. Perangkat lunak dari sistem akan menentukan jumlah droplet yang positif dan negatif untuk setiap fluorofor (misalnya, FAM dan HEX atau VIC) di setiap sampel. Fraksi droplet positif kemudian dianalisis dengan distribusi Poisson untuk menentukan jumlah salinan DNA awal secara absolut dalam satuan salinan/µl sampel.
 Kuantifikasi DNA dengan ddPCR tanpa Terpengaruh Efisiensi Reaksi PCR
Kuantifikasi DNA dengan ddPCR tanpa Terpengaruh Efisiensi Reaksi PCR
Droplet Digital PCR ddPCR memiliki sensitivitas lebih tinggi dibandingkan generasi PCR sebelumnya karena adanya proses partisi. Proses tersebut membuat ddPCR lebih toleran terhadap inhibitor reaksi PCR atau perubahan suhu penempelan primer saat proses amplifikasi. Berbeda dengan real-time PCR dimana perubahan suhu sangat mempengaruhi efisiensi reaksi, yang secara langsung akan berpengaruh pada nilai Cq amplifikasi dan penghitungan nilai salinan DNA (kuantifikasi DNA), perubahan suhu pada ddPCR akan berpengaruh terhadap intensitas floresensi reaksi namun tidak pada penghitungan nilai salinan DNA.
Hal tersebut karena sistem pengukuran ddPCR berbeda dengan real-time PCR. Real-time PCR mengukur akumulasi floresensi pada satu sampel, sedangkan ddPCR mengukur akumulasi floresensi pada setiap droplet, dimana satu sampel akan mengandung ribuan droplet.
Baca juga : Cara Deteksi Cepat Salmonella dengan Bio-Rad Salmonella Solutions
Kuantifikasi DNA dengan Presisi Tinggi menggunakan ddPCR
Droplet Digital PCR ddPCR dapat membedakan jumlah salinan DNA pada setiap sampel yang memiliki perbedaan nilai Cq hingga 0,3 Cq di Real-time PCR. Hal tersebut karena sistem analisis ddPCR menggunakan teknologi mirip seperti flow cytometry sehingga memiliki sensitivitas dan presisi yang sangat tinggi. Berbeda dengan teknologi digital PCR lainnya yang mengadopsi sistem analisis seperti real-time PCR. Presisi tinggi sangat penting untuk analisis DNA dengan konsentrasi rendah atau sampel-sampel yang memiliki salinan DNA dengan nilai perbedaan yang sangat kecil, sebagai contoh apabila kita ingin melakukan penelitian variasi jumlah salinan DNA pada sampel yang homogen.
Penulis : Ahmad Furqoni M.Si
Editor : Agung Nurfaizal
Phone : 021 5366 7591
Email : [email protected]
WhatsApp : 0855 1288 801
Kunjungi media sosial kami dan blog Offical Sciencewerke:
Instagram: https://www.instagram.com/sciencewerke_id/
Linkedin: https://www.linkedin.com/company/pt-sciencewerke/